sujet physique bac
Publié le 18/04/2024
Extrait du document
«
Terminale Sujet n°1
Exercice n°1 : Acide sulfamique (3 points)
Données : Électronégativité χ(H) = 2,2 et χ(O) = 3,4
L’acide sulfamique fait partie du couple acide-base suivant :
H2N–SO3H / H2N–SO3-.
a.
La représentation de Lewis de l’acide sulfamique est donnée ci-contre.
Justifier le caractère acide de l’atome d’hydrogène représenté en bas.
b.
Écrire l’équation de la réaction (considérée comme totale) entre l’acide sulfamique et l’eau.
c.
On souhaite doser une solution commerciale d’acide sulfamique H2N–SO3H, de concentration
inconnue.
Comme une solution aqueuse d’acide sulfamique contient les ions issus de la réaction
acidobasique précédente, on peut utiliser un dosage par étalonnage conductimétrique pour
déterminer sa concentration.
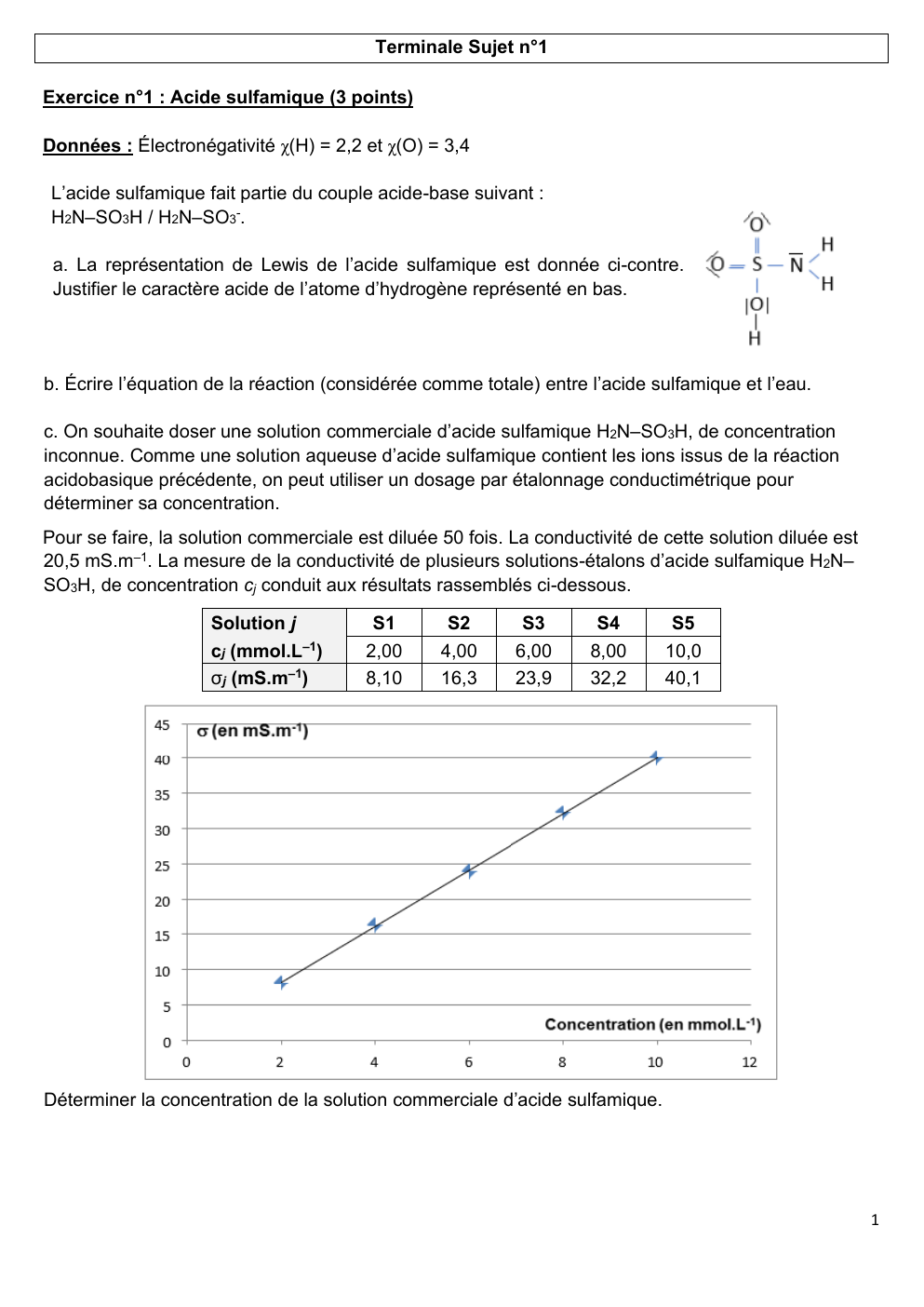
Pour se faire, la solution commerciale est diluée 50 fois.
La conductivité de cette solution diluée est
20,5 mS.m–1.
La mesure de la conductivité de plusieurs solutions-étalons d’acide sulfamique H2N–
SO3H, de concentration cj conduit aux résultats rassemblés ci-dessous.
Solution j
cj (mmol.L–1)
σj (mS.m–1)
S1
2,00
8,10
S2
4,00
16,3
S3
6,00
23,9
S4
8,00
32,2
S5
10,0
40,1
Déterminer la concentration de la solution commerciale d’acide sulfamique.
1
Exercice n°2 : Réduire l’acidité d’un lac (7 points)
Plusieurs lacs acides sont répartis dans le monde entier.
Cette acidité peut avoir des causes
naturelles (comme les éruptions volcaniques) ou être dues aux activités humaines.
Pour lutter contre
l’acidification d’un lac, deux méthodes sont possibles : diluer ou procéder à un chaulage (Doc 1).
Document 1 : Le chaulage
- Le chaulage est une technique agricole utilisée pour augmenter le pH d’un sol en y épandant des
espèces chimiques basiques, comme l’ion carbonate issu du carbonate de calcium solide.
Cette
même technique est également utilisée pour corriger le pH de lacs trop acides, où les écosystèmes
souffrent de l’excès d’acidité.
Dans ce cas, de la chaux est larguée par hélicoptère.
- « Chaulage » provient de « chaux » qui désigne l’oxyde de calcium de formule CaO.
Le carbonate
de calcium est préféré à la chaux, car plus soluble dans l’eau.
Document 2 : Le lac Delage
- Le lac Delage est situé au nord de la ville de Québec.
Il alimente en eau une partie de la ville LacDelage.
Son volume est estimé à V = 5,0 x 106 m3.
- Le pH du lac Delage est de 5,5, mais il faudrait le relever à 6,0.
Données : Carbonate de calcium de formule CaCO3 (s) ; masse molaire : M = 100 g.mol-1
1.
Méthode par dilution
Le but est de déterminer le volume d’eau à ajouter pour que le pH du lac passe de 5,5 à 6,0.
1.1.
Donner la définition du pH en précisant les grandeurs et leurs unités.
1.2.
Calculer la concentration initiale en ions H3O+ notée [H3O+]i et la concentration finale souhaitée
en ions H3O+ notée [H3O+]f.
1.3.
Déterminer le volume Veau à ajouter lors de la dilution pour atteindre le pH voulu.
2.
Méthode par chaulage
- Le carbonate de calcium est très soluble dans l’eau suivant la réaction totale :
CaCO3 (s) → Ca2+(aq) + CO32- (aq) (réaction 1)
- Les ions carbonate CO32- (aq) réagissent avec les ions H3O+ selon la réaction supposée totale :
CO32- (aq) + H3O+ → HCO3- (aq) + H2O (ℓ) (réaction 2)
2.1.
Parmi les deux réactions précédentes, laquelle est une réaction acidobasique ? Justifier votre
réponse.
2.2.
Préciser les deux couples acidobasiques de la réaction acidobasique.
2.3.
En utilisant les résultats de la question 1.2., montrer que la quantité n d’ions H3O+ qui doivent
réagir avec les ions carbonate CO32- (aq) lors du chaulage afin de diminuer le pH du lac vaut :
n = 1,1 x 104 mol.
2.4.
En déduire la masse de carbonate de calcium à utiliser lors du chaulage.
2
Terminale Sujet n°2
EXERCICE 1 : TRAITEMENT ANTI-ACARIEN (11 points)
Le varroa (destructor) est un acarien qui parasite les abeilles
et entraîne la destruction de très nombreuses colonies
d’abeilles dans le monde.
L’utilisation d’un diffuseur contenant une solution d’acide
méthanoïque permet de l’éradiquer.
Cet exercice porte sur l’étude de quelques propriétés de
l’acide méthanoïque, puis sur la détermination de la
concentration en acide méthanoïque d’une solution
commerciale pour la comparer à l’indication donnée par le
fabricant : solution aqueuse contenant 65,0 g d’acide
méthanoïque pour 100 mL de solution.
Données :
-
Formule développée de l’acide méthanoïque :
-
Masse molaire moléculaire de l’acide méthanoïque : M = 46,0 g⋅mol−1.
Extrait de table de spectroscopie infrarouge :
Liaison
O – H alcool
O – H acide
carboxylique
C–H
C=O
Nombre d’onde (cm−1)
3200 – 3700
Caractéristiques de la bande d’absorption
forte, large
2600 – 3200
forte à moyenne, large
2800 – 3100
1650 – 1740
forte ou moyenne
forte, fine
Propriétés de l’acide méthanoïque
1.
Citer la définition d’un acide selon la théorie de Brönsted et donner les noms de deux acides usuels.
2.
Donner la formule de l’ion méthanoate, base conjuguée de l’acide méthanoïque.
3.
Parmi les trois spectres infrarouge A, B et C ci-après, identifier celui pouvant être attribué à l’acide
méthanoïque.
Justifier la réponse.
3
Titrage de l’acide méthanoïque contenu dans la solution commerciale de traitement anti-acarien
Un titrage de l’acide méthanoïque contenu dans une solution commerciale de traitement anti-acarien par une
solution aqueuse d’hydroxyde de sodium est réalisé en mettant en œuvre le protocole suivant.
Protocole du titrage :
•
Diluer 1 000 fois la solution commerciale.
•
Prélever un volume Va = 20,0 mL de la solution diluée Sa de concentration C0.
•
Titrer le prélèvement par une solution aqueuse d’hydroxyde de sodium (Na+(aq) + HO−(aq)) de
concentration Cb = 2,00×10−2 mol⋅L−1.
Le suivi du titrage est effectué par pH-métrie.
•
Utiliser un tableur-grapheur dans lequel sont entrées les différentes valeurs du pH mesurées en
fonction du volume Vb de solution d’hydroxyde de sodium ajoutée.
4.
Faire un schéma légendé du dispositif expérimental utilisé pour réaliser le titrage.
5.
Écrire, sans justifier, l’équation de la réaction support du titrage.
6.
Montrer que la concentration d'acide méthanoïque de la solution diluée déterminée expérimentalement
est égale à C0 = 15,0×10−3 mol⋅L−1.
Dans les conditions de l’expérience, les incertitudes-type sur la concentration Cb et sur les volumes Va, Véq
(volume à l’équivalence) sont les suivantes :
u(Cb) = 0,02×10−2 mol⋅L−1
u(Va) = 0,2 mL
u(Véq) = 0,5 mL
L’incertitude-type sur la concentration C0 d’acide méthanoïque dans la solution diluée est déterminée à partir
des valeurs et incertitudes-type sur Ca, Va et Véq à partir de l’expression suivante :
u(C0 ) = C0 .
(
u(Cb ) 2 u(Va ) 2 u(Véq ) 2
) +(
) +(
)
Cb
Va
Véq
4
7.
Écrire le résultat de la mesure de la concentration expérimentale C de la solution commerciale assortie
de son incertitude, sachant que dans les conditions expérimentales :
u(C ) u(C0 )
=
C
C0
8.
Confronter la concentration C obtenue expérimentalement à la concentration indiquée par le fabriquant
Cfab en calculant le quotient ci-dessous.
Conclure.
C − Cfab
u(C )
EXERCICE 2 : ENCRE ET EFFACEUR (9 points)
5
Q5.
Calculer le pourcentage massique en bleu d’aniline de l’encre contenue dans la cartouche.
Conclure.
La réaction support de titrage est la suivante : SO32–(aq) + 2 OH–(aq) + I2(aq) → SO42–(aq) + H2O(ℓ) + 2 I–(aq)
Q6.
Montrer que la quantité de matière d’ion sulfite 𝑛𝑆𝑂32− contenue dans un effaceur est voisine de 8 x 10–5 mol.
Q7.
En déduire le nombre de cartouches d’encre que l’on peut effacer avec un seul effaceur en supposant que la réaction
d’oxydoréduction entre le bleu d’aniline et les ions sulfite met en jeu une mole de bleu d’aniline pour une mole d’ions
sulfite.
6
Terminale Sujet n°3
Vous rédigerez le devoir avec rigueur et exprimerez les résultats avec un nombre de chiffres significatifs
correspondant à la précision des données.
Les réponses sans justifications ne seront pas prises en compte.
Exercice n°1 : Autour du nitrate d’ammonium (8 points)
Le nitrate d’ammonium est un solide ionique de formule NH 4NO3.
Il est utilisé en grande quantité
comme engrais mais il a aussi des applications courantes, on le trouve par exemple dans les poches
de froid instantané utilisées pour soulager les douleurs musculaires.
L’objectif de cet exercice est d’étudier des solutions aqueuses d’acide nitrique et d’ammoniaque, les
deux réactifs permettant la synthèse du nitrate d’ammonium.
Données :
➢ Conductivités molaires ioniques à 25°C :
λ(NH4+) = 7,35 mS.m2.mol–1 ; λ(Cl–) = 7,63 mS.m².mol–1 ; λ(H3O+) = 34,98 mS.m².mol–1 ;
➢ Masses molaires : M(HNO3) = 63,0 g.mol-1 ; M(NH4NO3) = 80,0 g.mol–1
1.
Préparation d’une solution d’acide nitrique nécessaire à la synthèse du nitrate
d’ammonium
Pour réaliser la synthèse du nitrate d’ammonium, on utilise une solution aqueuse S 2 d’acide nitrique
de concentration en quantité de matière égale à 1,0 mol.L –1 que l’on souhaite préparer à partir d’une
solution d’acide concentré.
L’étiquette d’une solution S1 d’acide nitrique concentré indique que le pourcentage massique en acide
nitrique HNO3 dans la solution est de 47 % c’est-à-dire que 100 g de solution contiennent 47 g d’acide
nitrique.
Afin de déterminer la masse volumique de la solution S1,....
»
↓↓↓ APERÇU DU DOCUMENT ↓↓↓
Liens utiles
- bac physique: CHAPITRE 01 : NOMENCLATURE EN CHIMIE ORGANIQUE
- Grand oral du bac : Sports LA FORME PHYSIQUE
- Grand Oral de Physique-Chimie : Améliorer les Imageries par Résonance Magnétique (IRM)
- Physique chimie - année 2000
- Exemple d'un sujet d'oral de bac de LLCE