DS physique: Dosage du colorant E127
Publié le 20/04/2025
Extrait du document
«
Exercice N°1 :
1.
Dosage du colorant E127 dans un révélateur de plaque dentaire
Q1.
Groupe A : groupe hydroxyle, fonction alcool ;
Groupe B : groupe carbonyle, fonction cétone ;
Groupe C : groupe carboxyle, fonction acide carboxylique.
Q2.
Diagramme de prédominance :
pKA1
H2Ery
0
prédomine
= 2,4
HEry
–
prédomine
pKA2
Ery
2–
14
7,0
= 3,8
pH
prédomine
pH révélateur
plaque dentaire
2–
Dans le révélateur de plaque dentaire, la forme Ery
prédomine car pH > pKA2.
Q3.
Le spectre d’absorption du colorant E127 présente un maximum d’absorption autour de
λ = 530 nm soit le vert d’après le cercle chromatique.
La couleur de la solution du révélateur de plaque dentaire est la
couleur complémentaire au vert, diamétralement opposée au vert sur le cercle chromatique, soit le rouge.
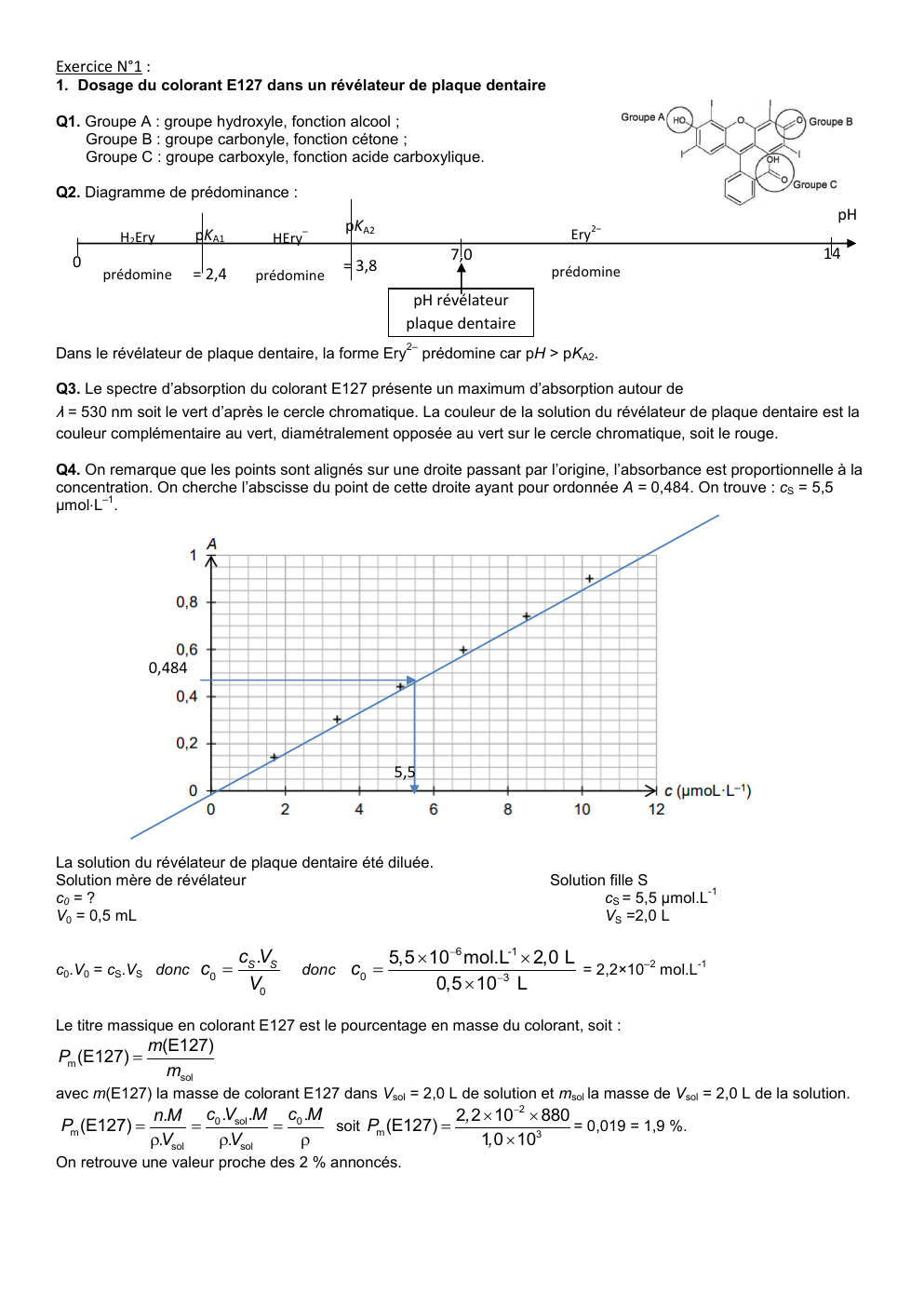
Q4.
On remarque que les points sont alignés sur une droite passant par l’origine, l’absorbance est proportionnelle à la
concentration.
On cherche l’abscisse du point de cette droite ayant pour ordonnée A = 0,484.
On trouve : cS = 5,5
–1
µmol⋅L .
0,484
5,5
La solution du révélateur de plaque dentaire été diluée.
Solution mère de révélateur
c0 = ?
V0 = 0,5 mL
c0.V0 = cS.VS
c .V
donc c0 S S
V0
Solution fille S
-1
cS = 5,5 µmol.L
VS =2,0 L
5,5 106 mol.L-1 2,0 L
–2
-1
donc c0
= 2,2×10 mol.L
3
0,5 10 L
Le titre massique en colorant E127 est le pourcentage en masse du colorant, soit :
Pm (E127)
m(E127)
msol
avec m(E127) la masse de colorant E127 dans Vsol = 2,0 L de solution et msol la masse de Vsol = 2,0 L de la solution.
Pm (E127)
2, 2 102 880
n.M c0 Vsol .M c0 M
soit Pm (E127)
= 0,019 = 1,9 %.
1, 0 103
Vsol
Vsol
On retrouve une valeur proche des 2 % annoncés.
2.
Synthèse de l’érythrosine à partir de la fluorescéine.
Q5.
L’étape 1 est l’étape de la transformation chimique.
L’étape 2 est l’étape de cristallisation et d’extraction de l’érythrosine.
L’étape 3 est l’étape d’identification de l’érythrosine.
Q6.
Dans l’étape 1 on chauffe le mélange réactionnel (à reflux).
La température étant un facteur cinétique, le
chauffage permet d’accélérer la réaction et donc d’augmenter la vitesse de formation de l’érythrosine.
n0 (H2Flu)
n (I )
et 0 2 qui correspondent aux proportions de l’équation de réaction.
1
4
n0 (H2Flu) 5, 0
n0 (H2Flu) m(H2Flu)
–2
soit
= 1,5×10 mol ;
1
332
1
M(H2Flu)
n (I )
9, 5
n0 (I2 )
m(I2 )
–3
soit 0 2
= 9,4×10 mol
4
4 254
4
4 M (I2 )
Q7.
Comparons les rapports :
Comme
n0 (I2 )
n (H Flu)
< 0 2
, le diiode I2 est le réactif limitant.
4
1
Autre rédaction : Déterminons l’avancement maximal relatif à chaque réactif.
Pour la fluorescéine H2Flu, n0 (H2Flu) xmax 0
xmax n0 (H2Flu)
m(H2Flu)
M (H2Flu)
5, 0
–2
= 1,5×10 mol
332
Pour I2 , n0 (I2 ) 4 xmax 0
n (I ) m(I2 )
xmax 0 2
4
4M(I2 )
xmax
xmax = 9,4×10
–3
mol
-3
Le réactif limitant est le diiode I2 car il conduit à l’avancement maximal le plus faible, xmax = 9,4×10 mol
Q8.
On exploite le rendement de la synthèse : r
mexp (H2Ery)
mmax (H2Ery)
donc :
mexp(H2Ery) = r .
mmax(H2Ery) avec r = 59 % = 0,59.
mexp(H2Ery) = r .
nmax(H2Ery).M(H2Ery)
mexp(H2Ery) = r .
xmax(H2Ery).M(H2Ery)
mexp (H2Ery) 0,59 9,35...
103 836 = 4,6 g.
Q9.
La quantité exp de H2Ery formée est :
n(H2Ery)
mexp (H2Ery)
M (H2Ery)
soit n(H2Ery)
4,6
–3
= 5,5×10 mol.
836
Cette quantité est égale à la quantité de colorant E127.
–2
–1
Un flacon de volume V = 10 mL et de concentration c0 = 2,2×10 mol⋅L en colorant E127 contient une quantité
n(E127) de colorant égale à :
–2
–3
–4
n(E127) = c0.V = 2,2×10 ×10×10 = 2,2×10 mol.
On peut donc fabriquer N =
5,5 103
= 25 flacons.
2,2 104
3.
Suivi cinétique de la décoloration d’une solution de colorant E127 par l’eau de Javel
d [Ery 2 ]
Q10.
La vitesse volumique de disparition de Ery a pour expression v = –
.
dt
d [Ery 2 ]
2–
Or
est égale au coefficient directeur de la tangente à la courbe représentative de [Ery ] en fonction du
dt
2–
temps.
2–
2–
Comme Ery est consommé, alors [Ery ] diminue et donc
d [Ery 2 ]
est négative.
dt
Plus la valeur de
d [Ery 2 ]
est négative et plus la vitesse est grande.
dt
Au début la tangente est fortement inclinée vers le bas, la vitesse est élevée.
Au fur et à mesure, la tangente est de moins en moins inclinée, la vitesse diminue.
2–
Le facteur cinétique à l’origine de cette évolution est la concentration en Ery qui est un réactif, sa diminution
progressive explique que la vitesse de disparation diminue.
Q11.
Le temps de demi-réaction t1/2 est égal à la durée nécessaire pour que l’avancement atteigne la moitié de sa
valeur finale.
2–
2–
2–
Ery est totalement consommé, donc quand x = xmax/2 alors [Ery ](t1/2) = [Ery ](t=0)/2.
On relie les points relatifs à l’expérience A.
-1
-1
On cherche l’abscisse du point d’ordonnée 8,5 µmol.L / 2 = 4,25µmol.L .
t1/2
On lit t1/2 = 150 s.
La réaction de décoloration est terminée au bout de 5t1/2, soit 5×150 = 750 s =....
»
↓↓↓ APERÇU DU DOCUMENT ↓↓↓
Liens utiles
- Grand Oral de Physique-Chimie : Améliorer les Imageries par Résonance Magnétique (IRM)
- bac physique: CHAPITRE 01 : NOMENCLATURE EN CHIMIE ORGANIQUE
- Physique chimie - année 2000
- Sujet Grand Oral Physique : Comment la physique a-t-elle contribué à l’évolution de l'aviation ?
- grand oral : physique : comment les loi de newton entre elle en compte dans un atterrissage sur mars,